近日,西南医科大学附属医院胃肠外科任磊博士后联合国内外多家科研机构在国际顶级学术期刊《Cancer Cell》(影响因子44.5,五年平均46.3)在线发表最新研究成果,论文题为 “Sensory neurons drive pancreatic cancer progression through glutamatergic neuron-cancer pseudo-synapses”。该研究首次发现并系统阐明了胰腺癌细胞与外周神经通过“癌症-神经元伪突触”(pseudo-synapses)直接交流信号的全新机制,从根本上拓展了癌症神经科学的研究边界。
研究首次提供了脑外实体瘤与神经形成功能性突触的直接证据,提出了“癌症-神经伪突触”新概念,并系统展示了从形态学、功能学到分子机制及体内验证的完整证据链。成果不仅揭示了胰腺导管腺癌高度神经侵犯的机制根源,也为靶向癌-神经互作的新型治疗策略提供了理论依据与转化方向。该论文的发表标志着西南医大附院在癌症神经科学领域取得了重要突破。
iNature
胰腺导管腺癌(PDAC)是一种高度致命的恶性肿瘤,在全球范围内是导致肿瘤相关死亡率的主要因素之一。
该研究证明了在癌症,即胰腺导管腺癌(PDAC)中,感觉神经末梢和癌症细胞之间存在假突触连接。这些突触位点在癌症细胞上表现出谷氨酸能N-甲基-D天冬氨酸受体(NMDA)受体亚基NMDAR2D(GRIN2D)的选择性富集,这使PDAC细胞对神经衍生的谷氨酸产生反应,并促进肿瘤生长和扩散。有趣的是,神经元通过神经癌假突触处的GRIN2D型谷氨酸受体将共同培养的PDAC细胞的子集转化为钙反应细胞。研究发现,该亚基的表达是由于神经营养前馈回路中感觉神经支配提供的谷氨酸可用性增加。此外,在这些神经癌假突触中对谷氨酸盐-GRIN2D信号的干扰显著提高了体内存活率。外周癌神经假突触的发现可能为癌症神经科学指导的肿瘤治疗提供了机会。

人类PDAC表现出异常高的神经侵袭(NI)和神经可塑性改变发生率。浸润神经的癌症细胞将其作为传播的导管,导致广泛的局部侵袭,使手术干预变得不可行,并引发严重疼痛。PDAC中NI的严重程度是整体无病生存率和局部复发的独立预后因素。与NI的预后意义一致,感觉和交感神经均已被证明可促进小鼠PDAC中的肿瘤发生和肿瘤侵袭性。值得注意的是,虽然小鼠PDAC中感觉-神经-胰腺癌症相互作用的机制已部分阐明,但其范围主要局限于旁分泌信号通路。
中枢神经系统的原发性和转移性肿瘤先前已被证明在中枢神经系统神经元和癌症细胞之间的突触谷氨酸信号作用下蓬勃发展。尽管L-谷氨酸是外周背根神经节(DRG)感觉神经元的主要神经递质,感觉神经元和外周癌症细胞(如PDAC细胞)之间存在谷氨酸介导的突触相互作用,但尚未探索。
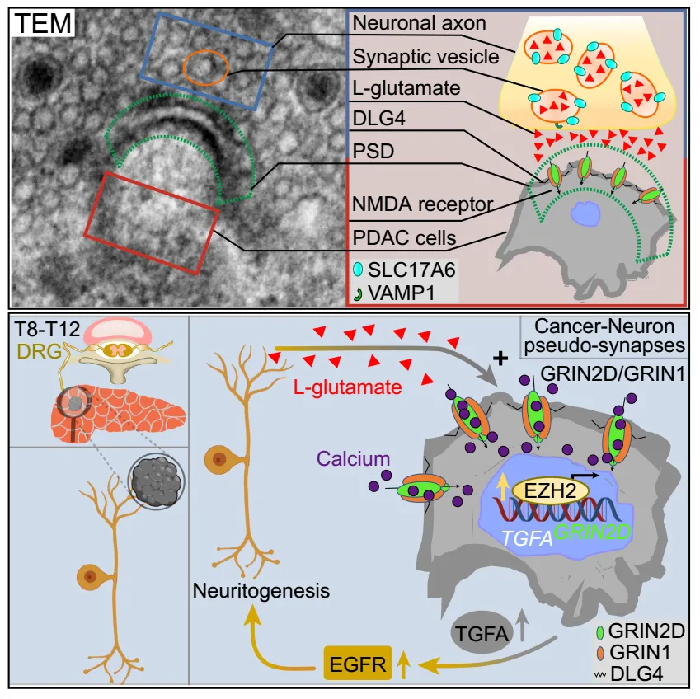
机理模式图(图源自Cancer Cell)
受NI在PDAC中的预后意义和突触谷氨酸信号在中枢神经系统癌症中的关键作用的驱动,研究人员探究了外周感觉神经元和癌症脑外细胞之间类似的、以前未探索的突触谷氨酸信号相互作用的潜在存在。该研究证明了感觉神经元和胰腺导管腺癌(PDAC)细胞之间的假突触连接。这些假突触表现出NMDA受体亚基GRIN2D/GluN2D的富集,增强PDAC对神经元来源的谷氨酸的反应性,促进肿瘤生长。假突触中谷氨酸-GRIN2D信号的破坏提高了PDAC的存活率,突出了靶向癌症-神经突触的治疗潜力。该研究可能会促进癌症神经科学指导下的肿瘤疗法的发展,利用非血脑载体穿透药物GRIN2D-NMDAR抑制剂来靶向该途径,具有潜在的宽治疗窗口和对中枢神经系统的最小副作用。

(西南医科大学附属医院 供稿)






